【P#19】医薬品の開発(7)〜薬価(1)
医薬品の開発において薬価制度(薬の値段が決まる制度)の理解は大切だ。というのも臨床試験を設計する際に、どのような評価項目(エンドポイント)で行うのか? が大事。
高い薬価を取るためにはに、既存の治療薬との比較で決まるからだ。そして、薬価というのは一度決まると、それ以上高くなることはなく、以下述べるように2年おきに減額されていくからだ。

開発本部は、如何に早く承認を取るのか?という目標で行われているため、マーケティングのプロダクトマネージャーが開発本部の中に入って高い薬価がとれるような設計になっているかどうか、チェックするケースが増えてきている。

薬局・薬店で売られている大衆薬(いわゆる一般用医療薬またはOTC(Over the counter drug))の値段は市場原理によって自由に決められている。
医療用医薬品(処方箋医薬品)は、「薬価基準」という公定価格がある。薬価基準は国(=厚生労働大臣)によって定められた医療用医薬品の公定価格のこと。この「薬価(NHI(National Health Insurance) price)」は、保険者から医療機関に支払われる薬剤の価格であると同時に、建前上、医療機関・薬局が卸から購入する際の薬の価格でもある。
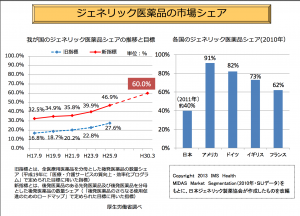
建前上、薬からの利益は生まれない形になっているが、医療用医薬品の納品価格は、原則的に市場原理によって働いていて、薬価を下回る価格での取引が行われている。この卸からの納品価格と保険者への請求価格(薬価)との間に差額が「薬価差益」となる。この薬価差益の問題が低薬価でマージンの低い後発医薬品の普及を遅らせているとも言われている(諸外国との比較を下記の図で示した(厚生労働省のデータより)。
かつては、製薬会社と医療機関の間の価格交渉を行い、納入価格を決定していた。仲介する医薬品卸(卸売一般販売業、以下卸)は注文のやりとりと代金回収のみに終始していた。実際、納入価格が製薬会社から卸への仕切価格よりも低いこともあった。この場合、差額を値引補償制度という形で製薬会社から補填されていた。当然、大学病院は潤う形にもなる。このようなことから、卸は「はじめに利権ありき」で本来の物流の効率化を図るという考えもなく単なる下請けとなっていた。問題だったのは、製薬会社の価格維持が可能となるシステムだったことであり、独占禁止法にも抵触するものであったことだ。
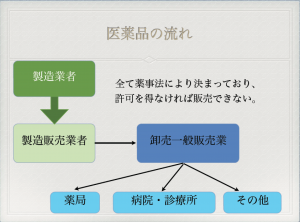
このような問題を解決するため1992年に「新仕切価制度(建値制度)」が導入された。これは、過去20年間にわたって続いていた値引補償制度を廃止することはもちろんのこと、医療機関と卸との交渉成立価格について、製薬会社が干渉を及ぼすことが禁止になった。つまり卸に納入時の仕切価格の交渉を自由に行えることができるようになった。
これ以降、製薬会社の医薬情報担当者(MR(Medical Representative))は情報の提供、収集、伝達活動に専念し、医療機関との交渉は卸の医薬品卸販売担当者(MS:Medical Marketing Specialist又はMarketing Specialist)が担うという役割分担が取られるようになった。ちなみに、MSは日本独特のものである。

医薬品は、薬事法に基づいて許可を受ければ販売可能となっているが、その大部分の医療用医薬品は保健医療の中で使用されているため、薬価基準に収載されていることが大事である。もちろん、薬価に収載されない薬としては、予防薬(インフルエンザワクチンなど)、対外診断用医薬品(ABO式血液型判定用医薬品)、生活改善薬(ピル・ED薬など)がある。これらは、医療用医薬品に含まれる。
薬価基準とは、保健医療において使用できる医療品の品目表とそれらの医薬品を使った場合における保険請求費用(薬剤費)の算定の基礎となる価格表の二つの側面からなっている。また、それに派生してくる「薬価基準制度」とは、その算定基準、引き下げ基準などのルール体系全体をあらわす言葉として使われる。

1990年までは、薬価差は薬剤費の20%、1兆5000億円だったが、国の努力によって現在減少している。薬価差の問題の対処のため厚生労働省は、2年に一度医療機関に対して、実態調査を行っている。市場実勢価格を把握するためだが、適正な薬価基準に反映させるため、薬価調査(市場価格調査)により実体を把握し、適宜に薬価は改正されている。通常薬価は2年に一度改正され、大部分の薬剤は減額される。

医療用医薬品は、薬事法に基づいて承認された後、医療保険の適用を受けるためには、薬価基準への収載手続きが必要とされる。薬価基準収載を希望する製薬企業は所定の申請書類に資料を添えて、新医薬品、報告品目、新キット製品、後発医薬品ごとに定められた期間内に厚生労働省医政局経済課(経済課)へ提出する。経済課で、製薬企業に対するヒアリングを実施後、申請された品目のリストを作成、保険局医療課(医療課)へ情報を伝達する。医療課では、資料に基づき算定原案を作成、中央社会保健医療協議会(中医協)の下部組織の薬価算定組織(医・歯・薬及び経済学の専門家10人によって構成される組織)で協議、委員の多意見を踏まえて新医薬品の価格を設定する。算定案については、不服があれば再度審議されるが、なければ算定案が決定される。中医協で算定案が承認された後、薬価収載(官報告示)される。
収載時期については以下のように決まっている(その年によって変わるが大まかなものとして)。
薬価基準収載頻度
新医薬品 年4回(承認は原則として60日以内、遅くとも90日以内)
キット品目 年2回(6月及び12月を標準)
後発医薬品 年1回(3月15日までに承認されたもの:7月収載を標準)
後発医薬品が薬価収載されると、品目数に関わらず、薬価に0.7を掛けたものが薬価として算定される。一方で、すでに収載されている場合には、薬価の安いものと同じ薬価が算定される。
薬価が実際にどのように決まるのか?そして、諸外国との違いについて次回触れたい。
****************************
医薬品については、時々書いています。下記をご参照ください。
ジェネリック医薬品と先発医薬品の違いは?何を知っていればいいのか?(「医薬品の開発(14)〜ジェネリック医薬品とは?先発医薬品とどう違うのか?値段は?」「医薬品の開発(15)〜ジェネリック医薬品とは?(2)〜どのように作られているのか?法律や品質の問題点について」参照)
医薬品の情報を見極めるためには「疫学」の知識が必要〜疫学とは何か?について(「医薬品の開発(13)〜『疫学』とは何か?〜医療情報をどのように判断するか?」参照)
審査書類は何を用意したらいいのか?製薬会社に勤めた過去の経験をベースに(「医薬品の開発(12)〜審査」参照)
米国の保険制度の特徴の一つはマネージドケア、その特徴について(「医薬品の開発(11)〜マネージドケア」参照)
医薬品は保険を財源としている〜保険の歴史、出来高払いと診療別包括払いの違いについて(「医薬品の開発(9)〜保険の仕組み(1)」「医薬品の開発(10)〜保険の仕組み(2)」参照)
処方箋医薬品の薬の値段(薬価)を決めるために、欧米ではエビデンスを重視するようになった(「医薬品の開発(8)〜薬価(2)〜仕組みと保険制度」参照)
処方箋医薬品は、国によって値段が決まっている〜どのような仕組みになっているのか(「医薬品の開発(7)〜薬価(1)」参照)
医薬品は特許で守られているが、どのような仕組みがあるのか(「医薬品の開発(6)〜特許と後発医薬品」参照)
国の審査が優先的に進む医薬品もある〜希少疾患、オーファン医薬品(「医薬品の開発(5)〜オーファン医薬品」参照)
製薬会社の審査は誰が行うのか?当局(国)の存在(「医薬品の開発(4)〜FDAと審査」参照)
医薬品の開発で何が重要になるのか?主要評価項目について(「医薬品の開発(3)〜エンドポイント」参照)
医薬品の審査には、製薬企業のお金が入っている現実(「医薬品の開発(2)〜TLOと事前相談費」参照)
医薬品の基本的な仕組み(「医薬品の開発(1)〜仕組み」参照)
*****************************









