【P#34】医薬品の開発(14)〜ジェネリック医薬品とは?先発医薬品とどう違うのか?値段は?
年々、医療費は増加しており、2017年(平成29年)にはついに42.2兆円になった(「厚生労働省のPress Release」より)。
42.2兆円といっても、ピンと来ない方がいらっしゃるかと思うが、実は、2019年の国家予算が約101兆円。
その約4割は医療費が占める計算になる。
もちろん、国はこれに対して危機意識を持っており、医療費を削減するために、様々な対策が取られている。

例えば、処方箋医薬品の薬価を改定(要は、医薬品の値段を下げること、薬価については「薬価(1)」参照)し、日本経済新聞によると、2019年10月に薬の公定価格(薬価)を3.2%程度引き下げる見通しだという(「薬価3.2%引き下げへ 厚労省見通し19年10月改定」参照)。
国が一番、取り組んでいる問題は、ジェネリック医薬品(後発医薬品)の普及だ。目標値の80%まであとわずかといったところで、対策が功を奏している(諸外国の割合に近づいている)。
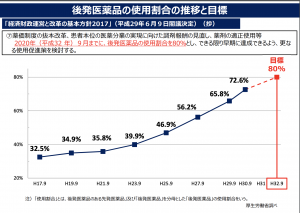
そして、2016年の生活保護法の改定により、生活保護者は、後発医薬品の使用原則化が決まっている(「生活保護法改正による後発医薬品の使用原則化について(生活保護法指定医療機関・指定薬局の皆様へ)」参照)。
そもそも
「後発医薬品とは何か?」
「先発医薬品とどう違うのか?」
について、どう判断していったらいいのか?製薬業界にいた自分でも理解できていないところがあるので、この機会に一度まとめてみたい。

医薬品は、「医療用医薬品(Ethical drug)」と「一般用医薬品(Over the Counter Drug:OTC薬、大衆薬ともいう)」に分けることができる。
一般用医薬品は、一般の人が自分で判断して使うことができる薬で、薬局で処方箋抜きで手に入れることができる。
医療用医薬品の中には、処方箋医薬品とそれ以外の医薬品に分かれる。
ポイントは、処方箋がなければ入手できないこと。
処方箋医薬品は
「薬局開設者又は医薬品の販売業者は、医師、歯科医師又は獣医師から処方せんの交付を受けた者以外のものに対して、正当な理由なく、又は授与してはならない」
と薬機法では定められていて「処方箋」なしでは販売できない。
このように、法律で縛りがあるので、自由に使うことができない(要は使用法を国は決めることができる)。
そして、処方箋医薬品の中に、先発医薬品と後発医薬品の2種類がある。
先発医薬品の特許が切れると、「後発医薬品」=「ジェネリック医薬品」を製造する製薬会社は後発医薬品を製造・販売できる(特許の詳細は「特許と後発医薬品」に書いた)。
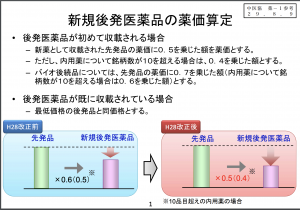
ジェネリック医薬品は、先発医薬品と治療学的に同等であるものとして製造販売が承認。研究開発に要するコストが低く抑えられることから、先発医薬品に比べて薬価を安くできる(「後発医薬品(ジェネリック医薬品)の使用促進について」参照)。
後発医薬品は、有効成分、投与経路、含量、用法・用量が同じで、効能・効果も同等な医薬品のこと。そして、健康な成人に先発医薬品と後発医薬品を投与し、血液中の濃度を測定。統計学的に同等(生物学的同等性試験)であると証明できれば、承認される。1984年に米国で、Hatch-Waxman(ハッチ・ワックスマン)法が制定されることで、参入できるようになった。

なぜ、政府は後発医薬品を推し進めようとしているのか?
それは、
1)先発品に比べ薬価=薬の値段が安い
2)先発品を含めた医療用医薬品の市場規模が大きいこと
だ。
薬価=薬の値段については「薬価(1)」に書いたが、
薬局・薬店で売られている一般用医療薬の値段は市場原理によって自由に決められるが、処方箋医薬品は、国(=厚生労働大臣)によって定められた「公定価格(国が決めた価格)」=「薬価基準」によって決まっている。
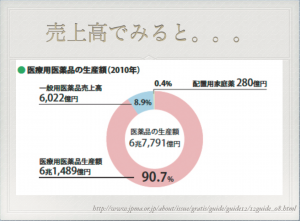
一般医薬品と処方せん医薬品(医療用医薬品)の売り上げ構成比をみるとわかるように(下記のスライド参照)、製薬会社にとって処方せん医薬品のは市場全体の9割を占め、利益率が高いので、ビジネス的に大きなメリットがある。
自ずと、製薬会社は処方箋医薬品に力を入れる。
しかし、特許が切れると、後発医薬品がゾロゾロと市場に参入する(ぞのため業界では「ゾロ品」とも呼ばれる)。
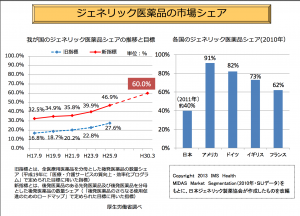
値段は、ジェネリック医薬品の薬価は先発品の価格に比べ、50〜70%。自ずとジェネリック医薬品市場が大きくなると、医療費削減に繋がっていく(上記のスライド参照)。
米国では、ジェネリック医薬品の販売を促進していくため、最初に市場に参入した医薬品については、180日の排他権(他の競合他社が参入できない)が与えられている。
そのために、ジェネリック医薬品の競争も激しく、現在ではインド、中国を含めた新興国が市場へ参入している。
現状では、ジェネリック医薬品の40%はインドで生産され、(先発、ジェネリック関係なく)医薬品の有効成分の80%はインドや中国で生産されている。なんと、米国の抗生物質の100%は国外で生産されているという。
このような現状があるにもかかわらず、インドや中国でどのように薬が生産され、医薬品の品質が本当に担保されているのか?
意外と知られていない。

ニューヨークタイムズやフォーブス誌に寄稿しているジャーナリストのKatherine Ebanの著書’Bottle of Lies: The Inside Story of the Generic Drug Boom‘には、ジェネリック医薬品の品質や生産現場を含め綿密な取材に基づいて一冊にまとまっている。残念ながら日本語訳がまだ出ていないが、2019年5月に発売されて以来、米国で話題になっており、興味深い内容だったので、次回取り上げたい。
****************************
医薬品については、時々書いています。下記をご参照ください。
ジェネリック医薬品と先発医薬品の違いは?何を知っていればいいのか?(「医薬品の開発(14)〜ジェネリック医薬品とは?先発医薬品とどう違うのか?値段は?」「医薬品の開発(15)〜ジェネリック医薬品とは?(2)〜どのように作られているのか?法律や品質の問題点について」参照)
医薬品の情報を見極めるためには「疫学」の知識が必要〜疫学とは何か?について(「医薬品の開発(13)〜『疫学』とは何か?〜医療情報をどのように判断するか?」参照)
審査書類は何を用意したらいいのか?製薬会社に勤めた過去の経験をベースに(「医薬品の開発(12)〜審査」参照)
米国の保険制度の特徴の一つはマネージドケア、その特徴について(「医薬品の開発(11)〜マネージドケア」参照)
医薬品は保険を財源としている〜保険の歴史、出来高払いと診療別包括払いの違いについて(「医薬品の開発(9)〜保険の仕組み(1)」「医薬品の開発(10)〜保険の仕組み(2)」参照)
処方箋医薬品の薬の値段(薬価)を決めるために、欧米ではエビデンスを重視するようになった(「医薬品の開発(8)〜薬価(2)〜仕組みと保険制度」参照)
処方箋医薬品は、国によって値段が決まっている〜どのような仕組みになっているのか(「医薬品の開発(7)〜薬価(1)」参照)
医薬品は特許で守られているが、どのような仕組みがあるのか(「医薬品の開発(6)〜特許と後発医薬品」参照)
国の審査が優先的に進む医薬品もある〜希少疾患、オーファン医薬品(「医薬品の開発(5)〜オーファン医薬品」参照)
製薬会社の審査は誰が行うのか?当局(国)の存在(「医薬品の開発(4)〜FDAと審査」参照)
医薬品の開発で何が重要になるのか?主要評価項目について(「医薬品の開発(3)〜エンドポイント」参照)
医薬品の審査には、製薬企業のお金が入っている現実(「医薬品の開発(2)〜TLOと事前相談費」参照)
医薬品の基本的な仕組み(「医薬品の開発(1)〜仕組み」参照)
*****************************






